مقص الجينات الذي سيغير البشرية: قصة تقنية كريسبر
مقص الجينات الذي سيغير البشرية: قصة تقنية كريسبر
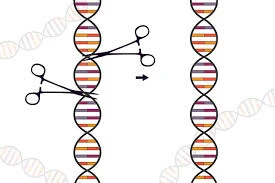
تخيل أن لديك القدرة على فتح "كتاب الحياة" - الحمض النووي (DNA ) - واستخدام "مقص" دقيق لتصحيح الأخطاء المطبعية التي تسبب أمراضًا مدمرة. تخيل أن بإمكانك تعديل النباتات لتنمو في ظروف قاسية أو القضاء على الأوبئة التي تنقلها الحشرات. هذا ليس خيالًا علميًا، بل هو الواقع الذي تقدمه لنا تقنية كريسبر (CRISPR-Cas9)، الأداة الثورية التي غيرت وجه الهندسة الوراثية إلى الأبد.
ما هي تقنية كريسبر؟ ولماذا هي بهذه الأهمية؟
ببساطة، كريسبر هي أداة لتحرير الجينات. فكر فيها كنظام "بحث واستبدال" حيوي. إنها مستوحاة من نظام دفاعي قديم موجود في البكتيريا، تستخدمه للتعرف على الفيروسات الغازية وتقطيع حمضها النووي لتعطيلها.
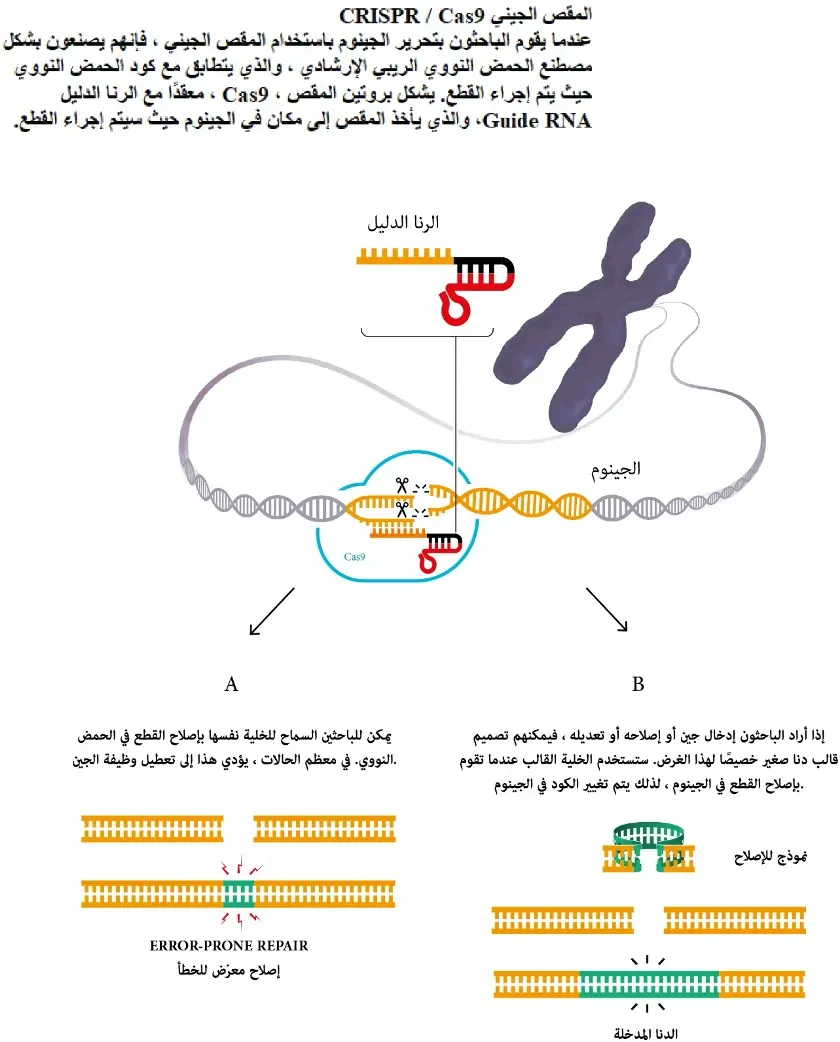
يتكون نظام كريسبر من جزأين رئيسيين:
- دليل RNA (gRNA): وهو جزيء مصمم ليتطابق مع تسلسل معين من الحمض النووي الذي نريد تعديله. إنه بمثابة "نظام تحديد المواقع" الذي يوجه المقص إلى المكان الصحيح تمامًا في الجينوم.
- بروتين Cas9: هذا هو "المقص الجزيئي". بمجرد أن يرشده دليل RNA إلى الهدف، يقوم هذا البروتين بقطع شريطي الحمض النووي بدقة متناهية.
بعد أن يتم القطع، تستخدم الخلية آلياتها الطبيعية لإصلاح الحمض النووي. وهنا تكمن العبقرية؛ يمكن للعلماء استغلال عملية الإصلاح هذه لإزالة جين غير مرغوب فيه، أو إضافة جين جديد، أو تصحيح طفرة مسببة للمرض.
لماذا أحدثت كريسبر ضجة هائلة؟ لأنها جعلت تحرير الجينات أسهل، أرخص، وأكثر دقة من أي وقت مضى. ما كان يستغرق سنوات وتكاليف باهظة في الماضي، يمكن الآن إنجازه في أسابيع قليلة وبجزء بسيط من التكلفة.
تطبيقات مذهلة... من الطب إلى الزراعة
الإمكانيات التي تفتحها كريسبر تكاد لا تكون محدودة. إليك لمحة عن بعض المجالات التي بدأت تُحدث فيها ثورة بالفعل:
- علاج الأمراض الوراثية: هذا هو الوعد الأكبر. يعمل العلماء على استخدام كريسبر لعلاج أمراض مثل فقر الدم المنجلي والتليف الكيسي. وقد تمت بالفعل الموافقة على أول علاج قائم على كريسبر لمرض فقر الدم المنجلي في بريطانيا والولايات المتحدة، مما يمثل لحظة تاريخية في الطب.
- مكافحة السرطان: يتم تعديل خلايا المناعة للمريض (الخلايا التائية ) وراثيًا باستخدام كريسبر لتصبح أكثر فاعلية في التعرف على الخلايا السرطانية ومهاجمتها. هذا النهج، المعروف باسم العلاج بالخلايا التائية CAR-T، يُظهر نتائج واعدة.
- ثورة في الزراعة: يمكن تعديل المحاصيل لتصبح أكثر مقاومة للجفاف والآفات والأمراض، وأكثر غنى بالعناصر الغذائية.
- القضاء على الأوبئة: يعمل الباحثون على تعديل البعوض وراثيًا لجعله غير قادر على نقل أمراض مثل الملاريا وحمى الضنك.
الجانب المظلم: تحديات أخلاقية عميقة
مع هذه القوة الهائلة، تأتي مسؤولية كبيرة وأسئلة أخلاقية معقدة تثير جدلاً واسعًا في المجتمع العلمي والعالمي:
- تعديل الأجنة البشرية (الخط الجرثومي): هذا هو الخطر الأكبر. إذا تم تعديل الحمض النووي في جنين، فإن هذه التغييرات لن تؤثر على الفرد فقط، بل ستنتقل أيضًا إلى الأجيال القادمة. هذا يفتح الباب أمام سيناريوهات "الأطفال المصممين" (Designer Babies)، مما قد يخلق فجوات اجتماعية وجينية هائلة بين البشر.
- الآثار غير المقصودة: لا تزال التقنية غير مثالية بنسبة 100%. هناك خطر حدوث "تعديلات خارج الهدف" (Off-target effects)، حيث يقوم المقص بالقطع في أماكن خاطئة من الجينوم، مما قد يؤدي إلى عواقب صحية غير متوقعة.
- العدالة والوصول: من سيتمكن من الوصول إلى هذه العلاجات باهظة الثمن؟ هل ستكون حكرًا على الأغنياء، مما يزيد من التفاوت الصحي العالمي؟
المستقبل بين أيدينا
تقنية كريسبر ليست مجرد أداة علمية، بل هي قوة يمكن أن تعيد تشكيل مستقبلنا. إنها تحمل وعدًا بالقضاء على أمراض عانت منها البشرية لآلاف السنين، ولكنها تثير أيضًا مخاوف عميقة حول معنى أن تكون إنسانًا. إن السباق لتطوير هذه التقنية مستمر، ولكن السباق الأهم هو السباق لوضع ضوابط أخلاقية وقوانين دولية تضمن استخدام هذه القوة المذهلة بحكمة ومسؤولية.
المصادر:
- "ما هي تقنية كريسبر لتعديل الجينات؟"، سكاي نيوز عربية.
- "What is CRISPR, and why is it so important?", BBC Science Focus.
- "The age of CRISPR is here", The Guardian.
- "CRISPR: A game-changing genetic engineering technique", Science (Journal).
- "He Jiankui and the ethics of CRISPR", Nature (Journal).