مقاومة الميكروبات : الحرب الصامتة وآليات الخداع البكتيري التي تهدد مستقبل الطب
المقدمة:
تعكس مقاومة الميكروبات (Antimicrobial resistance) للأدوية المخصصة لعلاجها تحديًا صحيًا عالميًا متصاعدًا، حيث تتسم هذه الظاهرة بقدرة البكتيريا والفيروسات والطفيليات والفطريات على تطوير آليات تُمكّنها من تحمّل تأثير المضادات الحيوية والأدوية المضادة للعدوى. تنشأ هذه المقاومة بشكل طبيعي أو تُكتسب نتيجة الاستخدام غير السليم والمفرط للمضادات الحيوية، مما يؤدي إلى توسعها عبر مجموعة واسعة من العوامل الممرضة. وتشير البيانات الحديثة إلى انتشار سريع للبكتيريا متعددة مقاومة الأدوية، مما يجعل العديد من أنواع العدوى الشائعة أكثر صعوبة في العلاج، بل وأحيانًا غير قابلة للعلاج بالخيارات الدوائية المتاحة حاليًا. ويثير هذا الواقع مخاوف جدية بشأن مستقبل فعالية المضادات الحيوية، بالنظر إلى تأثيره المباشر على صحة الإنسان والحيوان والنبات، وتهديده للنظام الصحي العالمي. [1]
يمثل تطور مقاومة الكائنات الدقيقة للمضادات الحيوية ظهور ظاهرة "الجراثيم الفائقة" (superbugs)، التي تشكل تحدياً حاسماً للعاملين في مجالات الرعاية الصحية والطب البيطري، بالإضافة إلى مقدمي خدمات صحة الحيوان. ويعود ذلك إلى تقلص فعالية العلاجات المتاحة للوقاية من الأمراض المعدية، والسيطرة عليها، وعلاجها. وبذلك، تواجه كل من الإنسان والحيوان صعوبة متزايدة في مكافحة العدوى، مما يعيدهم إلى حالة من الضعف أمام هذه الأمراض. [2]
تستعرض هذه المقالة آليات مقاومة البكتيريا الرئيسية، وتأثيرها على فعالية المضادات، وتسلط الضوء على الوضع الوبائي العالمي الحالية والحلول البديلة.
آليات مقاومة البكتيريا للمضادات الحيوية:
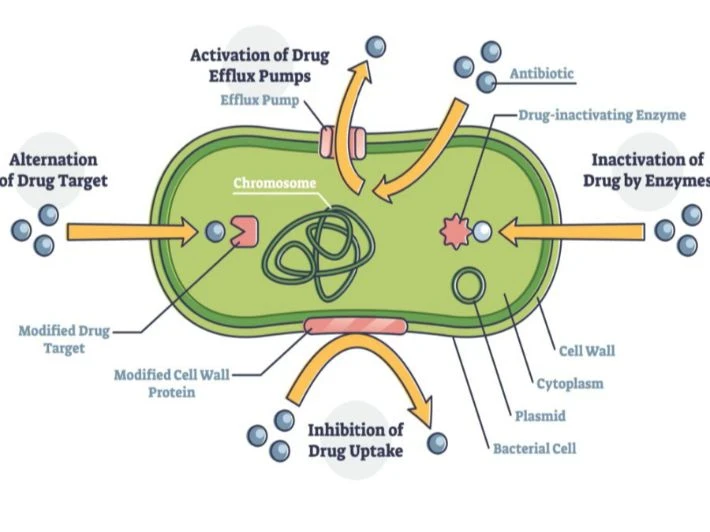
وفقًا لـ(Darby et al. (2023 تستند مقاومة البكتيريا للمضادات الحيوية إلى عدة آليات دقيقة ومتنوعة: [3]
1. تعطيل المضاد الحيوي (Antibiotic Inactivation)
تستخدم العديد من البكتيريا إنزيمات قادرة على تعطيل فعالية المضاد الحيوي عبر تحليله أو تعديله كيميائيًا، مما يمنع ارتباطه بالهدف الحيوي. وتشمل هذه الآليات تحلل المجموعات الوظيفية للمضاد
2. تعديل الهدف الحيوي (Target Modification)
تقوم البكتيريا بإحداث تغييرات جينية أو بنيوية في البروتينات أو الجزيئات التي ترتبط بها المضادات الحيوية، مما يقلّل من تقارب الدواء للهدف ويضعف تأثيره المثبط. وتشمل التعديلات الطفرات الجينية أو التعديلات التوافقية التي تغيّر شكل أو شحنة الهدف الحيوي.
3. تجاوز الهدف (Target Bypass)
تستطيع بعض البكتيريا إنتاج بروتينات أو مسارات بديلة تؤدي الوظيفة نفسها التي يثبطها المضاد الحيوي، ما يجعل الهدف الأصلي غير ضروري. يؤدي هذا إلى فقدان الدواء فعاليته حتى في وجوده ضمن الخلية البكتيرية.
4. تقليل النفاذية ( Reduced Permeability)
تقلل البكتيريا من دخول المضادات الحيوية عبر تغييرات في تركيب الغشاء الخلوي أو من خلال خفض التعبير عن البروينيات المسؤولة عن السماح للجزيئات بالعبور. تعد هذه الآلية شائعة في البكتيريا سالبة الغرام، إذ يساهم الغشاء الخارجي والبروينيات في التحكم بإمكانية وصول الدواء إلى داخل الخلية.
5. الطرد النشط (Active Efflux)
تعتمد بعض البكتيريا على مضخات غشائية تقوم بطرد المضاد الحيوي من داخل الخلية إلى خارجها بشكل مستمر، مما يخفض تركيزه الداخلي إلى مستويات غير مثبطة. توجد هذه المضخات في أنواع واسعة من البكتيريا، وتُعد من أكثر آليات المقاومة انتشارًا.
6. حماية الهدف (Target Protection)
في هذه الآلية، ترتبط بروتينات خاصة مباشرة بالهدف الحيوي، مما يمنع المضاد الحيوي من تثبيط وظيفته رغم وجود الدواء. تسمح هذه البروتينات باستمرار النشاط الحيوي للهدف مع تقييد تأثير المضاد.
7. دور تركيب الغلاف الخلوي في المقاومة
7.1 البكتيريا سالبة الغرام
تمتلك غشاءً مزدوجًا يوفر حاجزًا قويًا أمام المضادات الحيوية. تؤدي التغييرات في البروينيات، أو في تركيب الفسفوليبيدات، أو انخفاض النفاذية الطبيعية إلى تعزيز مقاومتها.
7.2 البكتيريا موجبة الغرام
ورغم افتقارها للغشاء الخارجي، فإن التعديلات في الغشاء السيتوبلازمي أو زيادة سماكة الجدار الخلوي قد تقلل دخول الدواء وتزيد المقاومة.
7.3 المتفطرات (Mycobacteria)
تتميز بطبقة شمعية غنية بالدهون وغطاء كبسولي كثيف، مما يقلل بشدة نفاذية الأدوية ويجعل علاج العدوى التي تسببها تحديًا كبيرًا.
8. مقاومة الأغشية الحيوية (Biofilm-Associated Resistance)
تتميز البكتيريا ضمن الأغشية الحيوية بتنظيم جيني وأيضي مختلف يقلل نفاذية المضادات ويؤدي إلى انخفاض النشاط الأيضي للخلايا، إضافة إلى تكوين خلايا مستمرة (persisters) وزيادة احتمال تبادل جينات المقاومة بين الخلايا داخل الغشاء الحيوي.
9. تغيّر النمط الحياتي وأنماط البقاء
9.1 الخلايا من نوع L-form
تفقد هذه الخلايا جدارها الخلوي تحت ظروف الضغط البيئي، ما يجعلها غير حساسة للمضادات التي تستهدف الجدار، مثل البيتالاكتامات.
9.2 الخلايا المستمرة (Persister Cells)
هي خلايا خاملة مؤقتًا تمتلك تحملًا عاليًا للمضادات خلال فترات الضغط، دون أن تحمل طفرات مقاومة حقيقية، وتعود لحساسيتها عند استئناف النمو.
9.3 التحمل (Tolerance)
تستطيع بعض البكتيريا البقاء تحت تركيزات مرتفعة من المضادات لفترات محدودة، مما يهيئ بيئة مناسبة لتراكم طفرات المقاومة الفعلية بمرور الوقت
الوضع العالمي للمقاومة والانتشار عبر الدول:
بين عامي 1990 و2021، أسهمت مقاومة الميكروبات للمضادات الحيوية (AMR) في وفاة أكثر من مليون فرد سنويًا على مستوى العالم. من المتوقع أن يُقدَّر العدد المباشر للوفيات الناتجة عن AMR خلال عام 2050 بنحو 1.91 مليون حالة، مع ارتفاع إجمالي الوفيات المرتبطة بالبكتيريا المقاومة من 4.71 مليون إلى 8.22 مليون حالة سنويًا. ويرتبط ذلك بانخفاض واضح في وفيات الأطفال دون سن الخامسة بنحو 50%، في حين يسجل كبار السن الذين تتجاوز أعمارهم 70 عامًا زيادة تفوق 80%. [4]
حيث تشير بيانات تقرير GLASS لعام 2021 الصادر عن منظمة الصحة العالمية إلى ارتفاع متواصل في مقاومة المضادات الحيوية في مناطق متعددة من العالم، خاصةً بين البكتيريا الشائعة مثل E. coli وKlebsiella pneumoniae. ويوضح التقرير أن نسب المقاومة ضد مضادات "الخط الأخير" مثل الكاربابينيمات أصبحت مقلقة بشكل خاص. كما يؤكد التقرير أن المستشفيات، وخاصة وحدات العناية المركزة، تُعد أماكن خصبة لانتشار هذه السلالات المقاومة نظرًا لشدة الحالات وتكرار استخدام المضادات هناك. [5]
ومن بين العوامل التي تسرع انتشار المقاومة على حسب WHO إساءة الاستخدام المفرط وغير المناسب للمضادات الحيوية، ونقص الوصول إلى مياه نظيفة وخدمات الصرف الصحي، وضعف الوقاية ومنع العدوى في مرافق الرعاية الصحية والمزارع، وانعدام الوعي المعرفي لدى المجتمع، ونقص القدرة على تشخيص الأمراض بسرعة وبتكلفة معقولة. هذه العوامل تفسر الانتشار عبر البشر والحيوانات والبيئة وتسهّل انتقال المقاومة عبر سلاسل الرعاية الصحية وسلاسل الغذاء [6]
التأثيرات والتداعيات السريرية والاقتصادية لمقاومة المضادات:
- تؤدي مقاومة الميكروبات للمضادات الحيوية إلى تفاقم الحالة السريرية للمرضى بشكل حاد. عندما تفشل المضادات الحيوية من الخط الأول في القضاء على العدوى، يحدث ما يلي:
[7]
فشل العلاج: Treatment Failure يحتاج المريض إلى استخدام علاجات بديلة قد تكون أقل فعالية أو تسبب آثارًا جانبية أكثر، مما يزيد من مدة معاناة المريض.
زيادة معدل الوفيات: Increased Mortality تشير الدراسات إلى أن العدوى بالبكتيريا المقاومة، خاصة المقاومة للكاربينيمات (CRE) أو الميثيسيلين (MRSA)، ترتبط بارتفاع احتمال وفاة المريض مقارنة بالعدوى التي تستجيب للأدوية. [8]
تعطيل الإجراءات الطبية المُنقِذة للحياة: تعتمد الإجراءات الطبية المعقدة مثل زراعة الأعضاء وجراحة القلب والعلاج الكيميائي للسرطان بشكل حاسم على قدرة المضادات الحيوية على الوقاية من العدوى ومعالجتها؛ وتفرض المقاومة تحدياً يهدد جدوى هذه الإجراءات الأساسية. [9]
الأثر الاقتصادي الباهظ لمقاومة المضادات الحيوية :
تُشكّل مقاومة المضادات الحيوية (AMR) عبئاً اقتصادياً متصاعداً لا يقتصر على صحة الفرد بل يهدد استدامة أنظمة الرعاية الصحية عالمياً حيث تتسع لتشمل:
زيادة مدة الإقامة في المستشفى: تتطلب العدوى المقاومة فترات علاج أطول، مما يزيد من معدل الإشغال في المستشفيات ويستهلك الموارد. [10]
ارتفاع تكاليف العلاج: غالبًا ما تكون مضادات الخط الأخير أعلى تكلفة بكثير، كما أن استخدامها يقتضي فحوصات مخبرية أكثر تعقيداً وتركيزاً. [11]
خسائر الإنتاجية: تؤدي الأمراض التي يصعب علاجها إلى فترات غياب طويلة عن العمل أو الدراسة، كذلك الوفاة المبكرة مما يؤدي إلى خسائر اقتصادية مباشرة على مستوى الأفراد والمجتمعات. [12]
الفجوة في البحث والتطوير: [13]
تتسبب المقاومة في سباق مستمر بين تطور الميكروبات وابتكار الأدوية الجديدة
تباطؤ اكتشاف المضادات الجديدة: على الرغم من الحاجة المُلحة، إلا أن معدل اكتشاف المضادات الحيوية الجديدة وتبنيها بطيء جدًا مقارنة بسرعة ظهور المقاومة.
غياب الحوافز الاقتصادية: صناعة الأدوية تجد أن الاستثمار في تطوير مضاد حيوي جديد أقل ربحية مقارنة بأدوية الأمراض المزمنة، مما يخلق فجوة في خطوط الأنابيب (Pipeline) للأدوية الجديدة، ما يعرف بـ "أزمة خط الأنابيب" أي تعني انه على الرغم من وجود بعض المنتجات في مراحل التطوير، إلا أن العدد الإجمالي يظل غير كافٍ على الإطلاق لسد الاحتياج العالمي، خصوصاً عند الأخذ في الاعتبار معدلات الفشل المرتفعة في المراحل المتأخرة من التجارب السريرية. [14]
استراتيجيات المكافحة والحلول:
أصبح من الضروري تبني استراتيجيات عالمية متعددة الأوجه تستند إلى مفهوم "الصحة الواحدة" (One Health)، الذي يقر بتواجد ترابط بين صحة الإنسان والحيوان والبيئة.
الوقاية والسيطرة على العدوى يُعدّ تطبيق إجراءات مكافحة العدوى الفعّالة النهج الأمثل للسيطرة على انتشار مقاومة مضادات الميكروبات. فتقليل العدوى يعني تقليل الحاجة لاستخدام المضادات الحيوية. [15]
دور الرعاية الصحية: يجب تشديد تطبيق بروتوكولات النظافة في المرافق، بما في ذلك نظافة اليدين وتحسين النظافة في المستشفيات، وعزل المرضى الذين يحملون سلالات مقاومة. [15]
التلقيح: تلعب اللقاحات دورًا حاسمًا في تقليل انتشار الأمراض البكتيرية والفيروسية، على عكس الأدوية، أقل عرضة لتكوين مقاومة لأنها تستهدف أمراضا محددة بدقة. وبذلك يتم خفض الطلب على المضادات الحيوية لعلاج العدوى الثانوية. على سبيل المثال، يقلل لقاح المكورات الرئوية من استخدام المضادات الموجهة لالتهاب الرئة. [16]
تحسين الصرف الصحي والمياه النظيفة: يساهم توفير المياه الآمنة والصرف الصحي المُحسَّن في البيئة والمجتمعات في كسر سلسلة انتقال العوامل الممرضة فهناك العديد من الأمراض المعدية التي تُعالج بالمضادات الحيوية، مثل الإسهال، يمكن الوقاية منها بسهولة عن طريق توفير إمدادات المياه الآمنة والصرف الصحي وبالتالي تقليل عبء الأمراض المعدية. [17]
الإشراف والاستخدام الرشيد للمضادات (Antimicrobial Stewardship - AMS) الهدف الأساسي هو ضمان استخدام المضاد الحيوي الأمثل، بالجرعة الصحيحة، وللمدة الصحيحة، وطريقة الإعطاء الصحيحة، فقط عندما يكون ضروريًا [18]
في الإنسان: يجب تطبيق برامج الإشراف (AMS) في المستشفيات والمراكز الأولية لتقليل الوصفات الطبية غير الضرورية للمضادات الحيوية، خاصة في حالات العدوى الفيروسية. ويشمل ذلك استخدام اختبارات التشخيص السريع (Rapid Diagnostics) لتحديد نوع الميكروب وحساسيته للدواء قبل البدء بالعلاج واسع الطيف. [18]
في الحيوان والزراعة: يجب حظر الاستخدام الروتيني للمضادات الحيوية لغرض تعزيز النمو (Growth Promotion) في الثروة الحيوانية، وتعزيز ممارسات الوقاية مثل التحسين الصحي للحيوانات والمحاصيل، والأمن البيولوجي، والبدائل غير الكيميائية. تعزيز الممارسات البيطرية الرشيدة التي تعتمد على الوقاية بدلاً من العلاج الجماعي. [19]
البحث والتطوير والحلول البديلة:
اكتشاف مضادات حيوية جديدة (Novel Compounds): يُعد أولوية بحثية رئيسية، حيث يجب تحفيز الجهود العلمية لاكتشاف مركبات مبتكرة بآليات عمل متميزة قادرة على التغلب على آليات المقاومة البكتيرية المعروفة. [20]
العلاجات البديلة (Alternatives): تشير الأبحاث الحديثة إلى فعالية استخدام الفاج (البالعات) وبروتيناتها المحللة في مكافحة العدوى البكتيرية المقاومة للمضادات الحيوية المتعددة، حيث يُعد علاج الفاج بديلاً أو مكملاً قوياً للمضادات الحيوية التقليدية. مع ذلك، يتطلب تطوير أساليب علاجية ووقائية جديدة ضد العدوى البكتيرية مراعاة عدة اعتبارات أساسية، مثل التحديات التنظيمية والأمان والفعالية السريرية. [21]
التشخيص المبتكر: تطوير أدوات تشخيص موثوقة وحساسة بأسعار معقولة يُعد أساسيًا لمواجهة خطر مقاومة مضادات الميكروبات، حيث يعزز العلاج السريع والفعال، حيث تُعتبر الأنظمة المتقدمة للمراقبة، مثل تطبيقات الهواتف المحمولة وبرامج الترصد، ضرورية لتتبع استهلاك مضادات الميكروبات بدقة وفي الوقت الفعلي. [22]
الخاتمة
في الختام، لا يمكن الحدّ من مقاومة الميكروبات للأدوية من خلال جهود فردية أو اعتماد قطاع واحد فقط، بل يتطلب ذلك استثمارًا مستدامًا في البحث العلمي ووسائل التشخيص السريع، إلى جانب التزام سياسي فعّال، وتعزيز الوعي المجتمعي، وتطبيقًا منسقًا لنهج «الصحة الواحدة» على مستوى دول العالم. ففعالية المضادات الحيوية، التي طالما اعتُبرت أمرًا بديهيًا، تُعدّ ركيزة أساسية في الطب الحديث، والحفاظ عليها مسؤولية عالمية مشتركة لضمان الأمن الصحي للأجيال القادمة.
المراجع
World Health Organization. (2023, November 17). Antimicrobial resistance. [1]
[2] World Organisation for Animal Health. (2022). Fighting antimicrobial resistance: A guide for veterinary authorities. Paris: World Animal Health Organization
[3] Darby, E. M., Trampari, E., Siasat, P., Solsona Gaya, M., Alav, I., Webber, M. A., & Blair, J. M. A. (2023). Molecular mechanisms of antibiotic resistance revisited. Nature Reviews Microbiology, 21(5), 280–295. https://doi.org/10.1038/s41579-022-00820-y
[4] GBD 2021 Antimicrobial Resistance Collaborators. (2024). Global burden of bacterial antimicrobial resistance 1990–2021: a systematic analysis with forecasts to 2050. The Lancet, 404(10459), 1199‑1226. https://doi.org/10.1016/S0140-6736(24)01867-1
[5] World Health Organization. (2021). Global antimicrobial resistance and use surveillance system (GLASS) report. WHO
[6] https://www.who.int/ar/news-room/fact-sheets/detail/antimicrobial-resistance
[7] Bassetti, M., et al. (2020). "The clinical and economic impact of antimicrobial resistance in the 21st century: current regulatory and scientific challenges." Future Microbiology
[8] Shrestha, N. K., et al. (2020). "Effect of carbapenem resistance on mortality and length of hospital stay in patients with bloodstream infections." Infection Control & Hospital Epidemiology
[9] " Antimicrobial resistance: Global report on surveillance 2017"
[10] Hutubessy, R., et al. (2016). "The global costs of antimicrobial resistance: A review of the current evidence." Health Affairs
[11] World Bank. (2017). "Drug-resistant infections: A threat to our economic future
[12] Cassini, A., et al. (2019). "Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis." The Lancet Infectious Diseases
[13] The Pew Charitable Trusts. (2021). "Antibiotics Currently in Global Clinical Development: An Analysis of the Clinical Pipeline and the Potential for Future Progress
[14] Walsh, F. (2018). "Antibiotic resistance: the challenge for new science."
[15] (WHO). (2020). "Guidelines on core components of infection prevention and control programmes at the national and facility level
[16] Alghamdi, S. (2021). Role of vaccines in combating antibiotic-resistant bacteria. Saudi Journal of Biological Sciences, 28(12), 7505–7510. https://doi.org/10.1016/j.sjbs.2021.08.054
[17] (UN). (2022). "Global action plan on antimicrobial resistance
[18] Barlam, T. F., et al. (2016). "Implementing an antimicrobial stewardship program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America." Clinical Infectious Diseases
[19] (WOAH). (2023). "OIE Strategy on Antimicrobial Resistance and the Prudent Use of Antimicrobials
[20] Rex, J. H., et al. (2022). "The role of public-private partnerships in addressing the antimicrobial resistance crisis." Nature Reviews Drug Discovery
[21] Kutter, E., et al. (2023). "Phage Therapy: An alternative to antibiotics." Current Opinion in Microbiology
[22] Timbury, P. C. (2019). "Rapid diagnostic tests for antimicrobial resistance." Journal of Antimicrobial Chemotherapy
[23] Laxminarayan, R., et al. (2020). "Access to effective antimicrobials and the global health challenge of resistance." The Lancet.